天然产物(+)-Heilonine的全合成
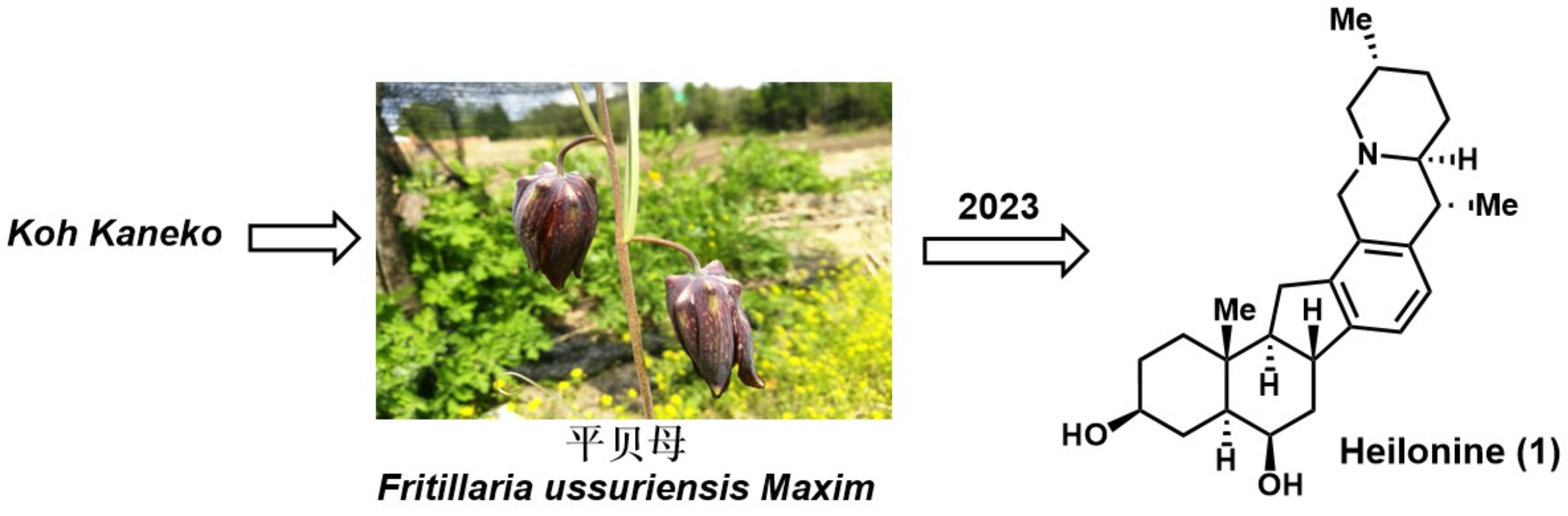
甾体生物碱因其独特的骨架和特殊的生物活性引起了众多科学家广泛的关注[1],如从百合科藜芦属植物中分离得到藜芦(Veratrum)生物碱就是其中之一。从结构上看,藜芦(Veratrum)生物碱具有共同的C-nor-D-homo甾体骨架,而根据其与哌啶环(F环)的连接方式可分为三类[2]:cevanine型、veratramine型和jervine型(图1)。Heilonine (1)就是cevanine型生物碱,是由日本科学家Koh Kaneko 教授及其同事于1989年从黑龙江省百合科植物平贝母Fritillaria ussuriensis Maxim.中分离获得[3] (图1),并且被认为是重要的中草药“贝母”的成分[4]。
图 1天然产物(+)-Heilonine的分离
(图片来源于J. Am. Chem. Soc)
天然产物(+)-Heilonine具有稠合的六环结构以及9个立体中心[5],如图 1所示。
芝加哥大学的Viresh H. Rawal教授团队在J. Am. Chem. Soc.上,以 “Enantioselective Total Synthesis of (+)-Heilonine”为题,首次以21步完成了(+)-Heilonine的全合成。
其全合成步骤如下:
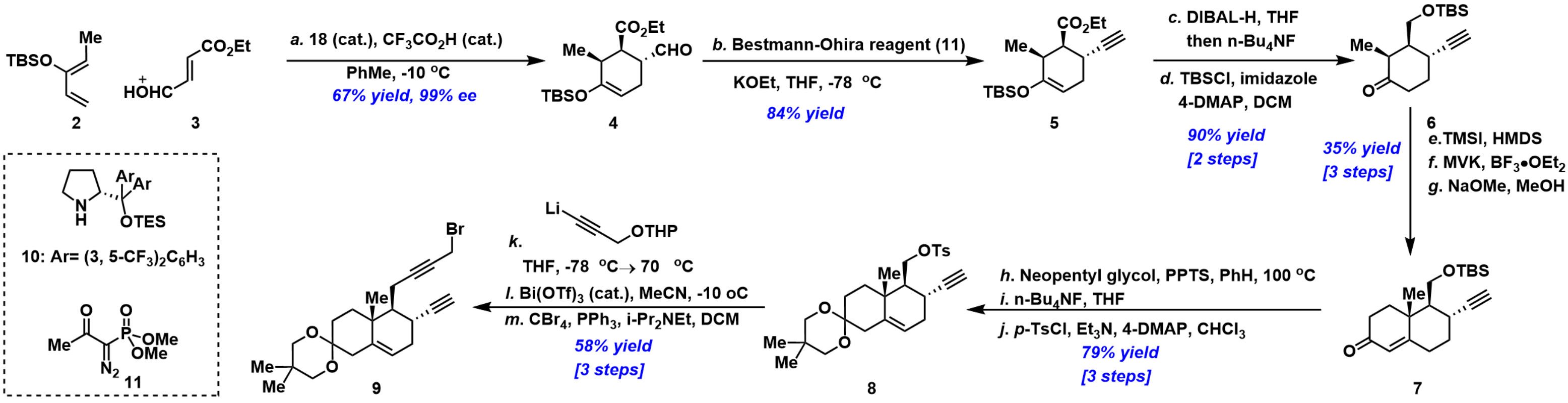
首先,对砌块9进行了合成,如图 2所示。即二烯2与亲双烯体3经不对称Diels–Alder反应[6]获得化合物4,4经Gilbert-Seyferth同系化[7]反应合成关键的炔中间体5。随后,5通过一锅法酯水解和烯醇硅醚水解以及羟基再保护两步获得砌块6,6经TMSI处理、Mukaiyama-Michael反应和NaOMe促进的关环三步获得稠环中间体7。7通过缩酮化、脱保护和磺酰化三步反应得到甲苯磺酰酯8。最后, Li衍生物处理化合物8,再经Bi(OTf)3脱THP保护和溴化三步获得片段9。
图 1片段9的合成
(图片来源于J. Am. Chem. Soc)
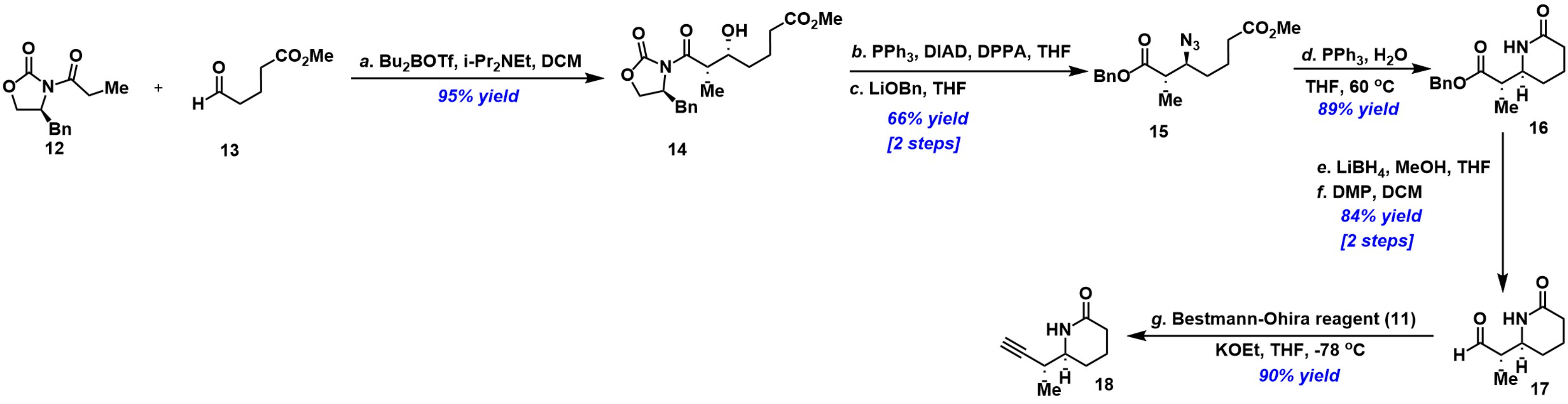
之后,对片段18进行了合成,如图 3所示。即以12和13为原料,通过不对称Evans aldol反应获得产物14,14通过Mitsunobu反应和LiOBn脱除手性助剂两步合成砌块15。15通过Staudinger反应得到内酰胺的产物16。16经过LiBH4还原和DMP氧化获得醛17。最后,醛17经Gilbert-Seyferth同系化反应合成关键的片段18。
片段18的合成
(图片来源于J. Am. Chem. Soc)
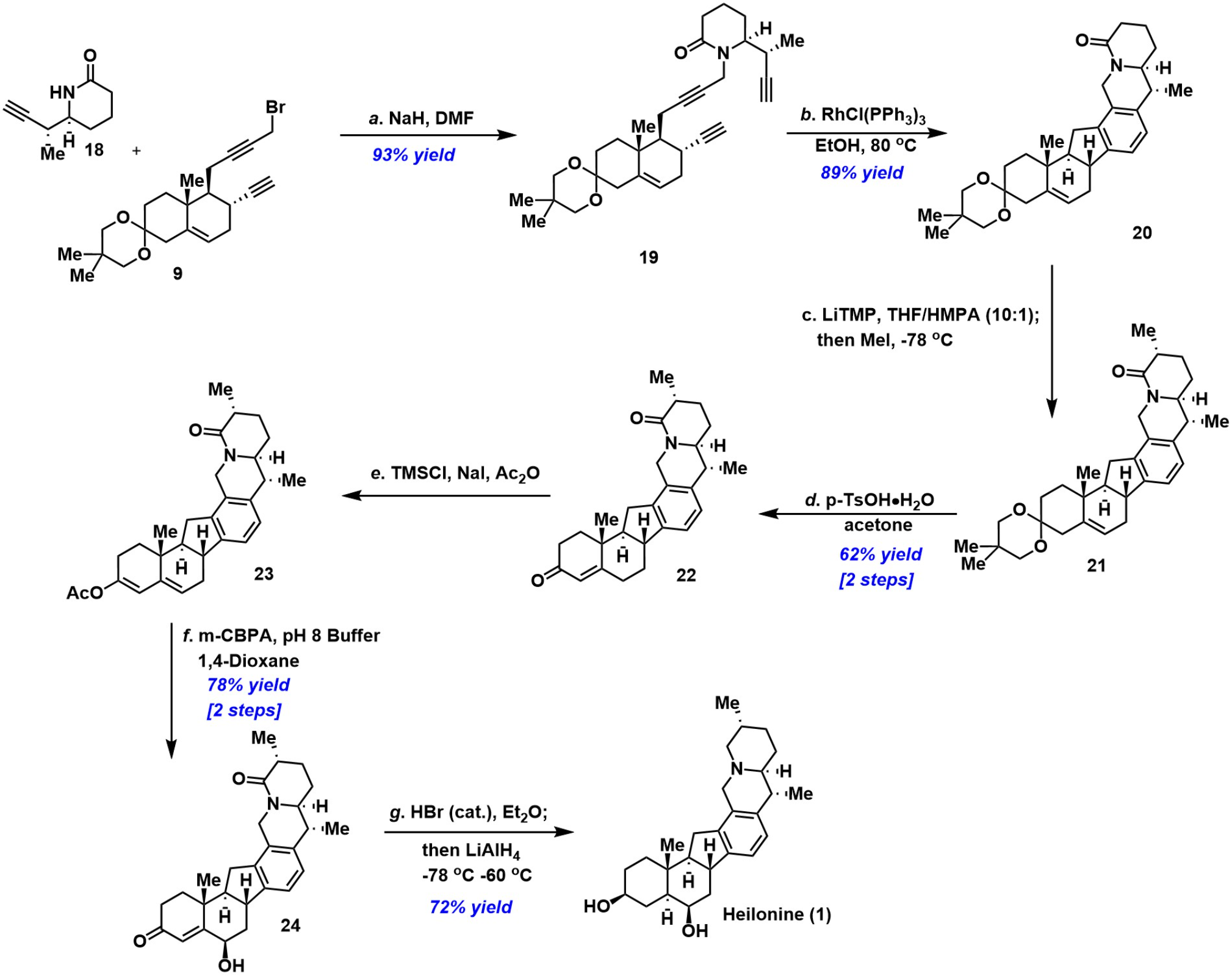
最后,片段9与片段18烷基取代反应获得三炔化合物19,19发生Rh催化[2+2+2]环化异构化[8]获得环化异构化产物20。20发生选择性甲基化获得中间体21。21经脱保护、Ac2O处理两步得到化合物23。23经m-CPBA氧化得到γ-羟基烯24。化合物24经HBr促进的异构化和LiAlH4还原即可完成天然产物 (+)-Heilonine(1)的全合成(图 4)。
片段18的合成
(图片来源于J. Am. Chem. Soc)
芝加哥大学的Viresh H. Rawal教授公布的 (+)-Heilonine的全合成关键步骤主要涉及:Rh催化的[2+2+2]环化异构化(Rh catalyzed[2 + 2 + 2] cycloisomerization reaction); 不对称Diels–Alder反应 (asymmetric Diels–Alder reaction ); Robinson环化 (Robinson annulation)等。
原文:“Enantioselective Total Synthesis of (+)-Heilonine Kyle J. Cassaidy and Viresh H. Rawal* J. Am. Chem. Soc., 2021, 143, 16394–16400 https://pubs.acs.org/doi/10.1021/jacs.1c08756
参考文献
- Q.-W. Jiang, M.-W. Chen, K.-J. Cheng, P.-Z. Yu, X. Wei, Z. Shi, Med. Res. Rev. 2016, 36, 119. doi: 10.1002/med.21346.
- H.-J. Li, Y. Jiang, P. Li, Nat. Prod. Rep. 2006, 23, 735. doi: 10.1039/B609306J.
- Y. Kitamura, M. Nishizawa, K. Kaneko, M. Shiro, Y.-P. Chen, H.-Y. Hsu, Tetrahedron 1989, 45, 7281. doi: 10.1016/S0040-4020(01)89188-2.
- X. Wu, S.-w. Chan, J. Ma, P. Li, P.-c. Shaw, G. Lin, J. Ethnopharmacol. 2018, 210, 39. doi: 10.1016/j.jep.2017.08.027.
- Y. Yamamoto, T. Arakawa, R. Ogawa, K. Itoh, J. Am. Chem. Soc. 2003, 125, 12143. doi: 10.1021/ja0358697.
相关化合物
| 品名 | CAS | 货号 |
|---|---|---|
| (R)-(-)-Linalool, 95% (sum of enantiomers) (R)-3,7-二甲基-1,6-辛二烯-3-醇 | 126-91-0 | C42831 |
| tert-Butyldimethylchlorosilane, 99% 叔丁基二甲基氯硅烷 , 99% | 18162-48-6 | 236144 |
| Ethyl acetate, 99.8%, for biochemistry, J&KSeal 乙酸乙酯 , 99.8% , 用于生物化学, J&KSeal瓶 | 141-78-6 | 925296 |
| N,N-Dimethylformamide, 99.9%, for synthesis N,N-二甲基甲酰胺 , 99.9% , 用于合成 | 68-12-2 | 914616 |
| N,N-Diisopropylethylamine, 99.5% N,N-二异丙基乙胺 , 99.5% | 7087-68-5 | 203402 |
相关阅读
七大系列,上万个产品,助力天然产物全合成研究!天然产物化学——助力提取、修饰、全合成、药理与代谢研究
光延反应的关键中间体——DEAD/DIAD,用于天然产物全合成