周剑教授团队科研成果|双功能硅试剂——反应性更好,立体选择性更高
时间: 2023-09-07
作者: 百灵威
分享:
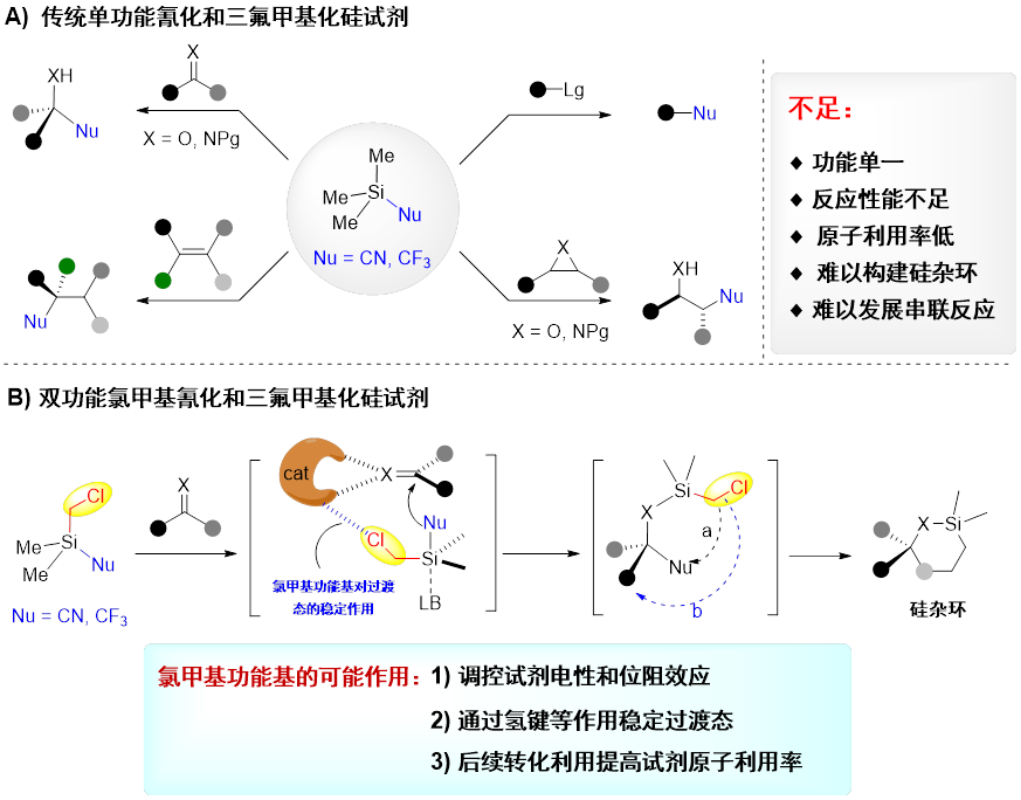
华东师范大学周剑教授团队针对传统氰化和三氟甲基化硅试剂(TMSCN和TMSCF3)功能单一、反应性能不足等缺点,发展了两类新型双功能硅试剂,并成功应用于构建系列季碳手性中心的不对称硅氰化反应和三氟甲基化反应。其主要特点如下(图1):
 本文将分别对这两类双功能氯甲基硅试剂在不对称反应中的应用与优势进行简要介绍。
本文将分别对这两类双功能氯甲基硅试剂在不对称反应中的应用与优势进行简要介绍。
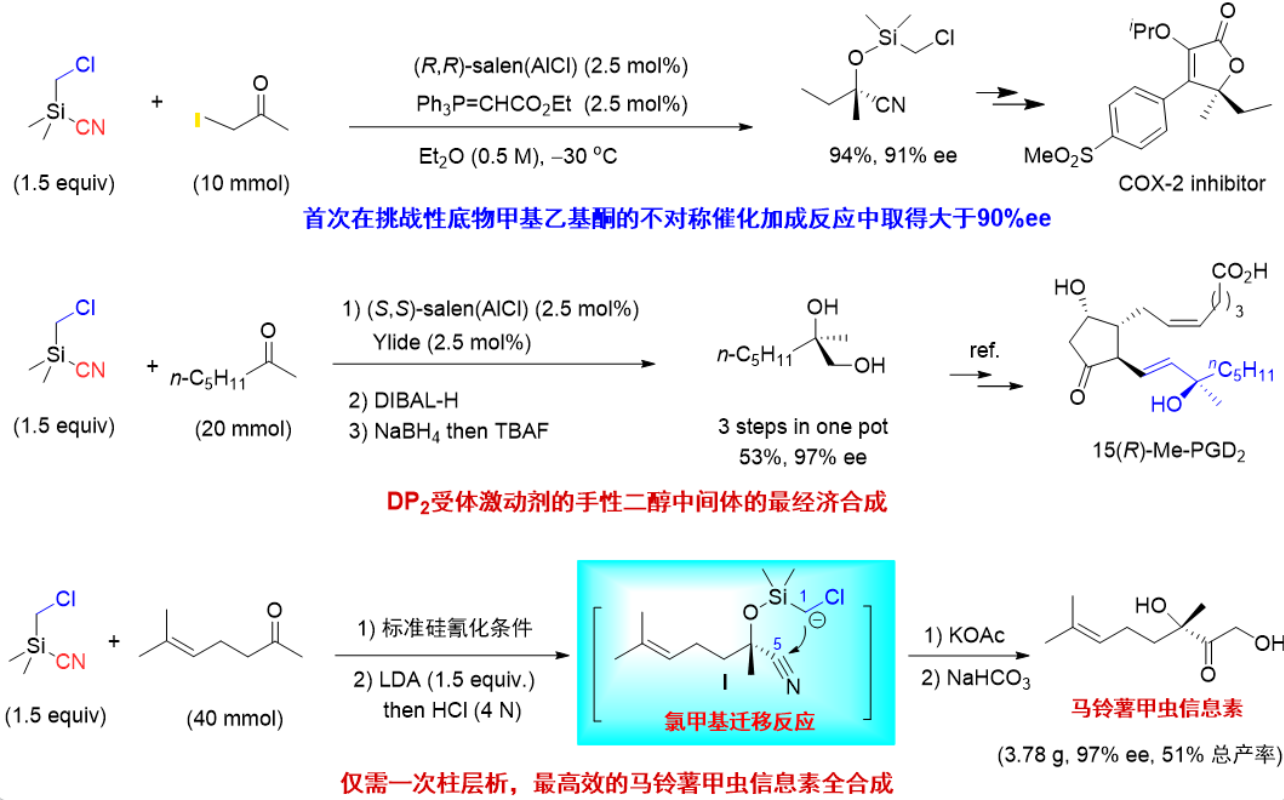
值得一提的是,周剑教授团队利用Me2(CH2Cl)SiCN不仅首次以91% ee值实现了挑战性的甲基乙基酮的不对称亲核加成反应,且该试剂在活性分子(如COX-抑制剂、DP2受体激动剂的关键中间体、马铃薯甲虫信息素)的合成方面具有重要应用(图3)。


TMSCF3
三甲基氟化试剂
周剑教授团队科研成果|新型双功能手性膦酰胺-胺催化剂
你的三氟甲基化问题解决了么?
陈庆云院士课题组科研成果 | 氟烷基化试剂——应用广,效率高
潘毅教授科研成果 | IMDN-Tf—一步实现三氟甲基化硼化,高效合成含氟功能分子
毕锡和教授科研成果 | 三氟甲基重氮甲烷(CF3CHN2)的新生——TFHZ-Tfs:安全,无毒,易操作
- 第二功能基氯甲基的引入可调控硅试剂的电性和位阻效应,或通过氢键等弱相互作用稳定反应过渡态,从而实现更好的反应活性和选择性控制;
- 与极性双键反应后,硅上的功能基可进一步通过形成“硅桥”促成一些其他方法无法实现的分子内转化,并提高硅试剂参与反应的原子利用率。

图1 双功能硅试剂的特点和利用模式
双功能硅试剂Me2(CH2Cl)SiCN的应用
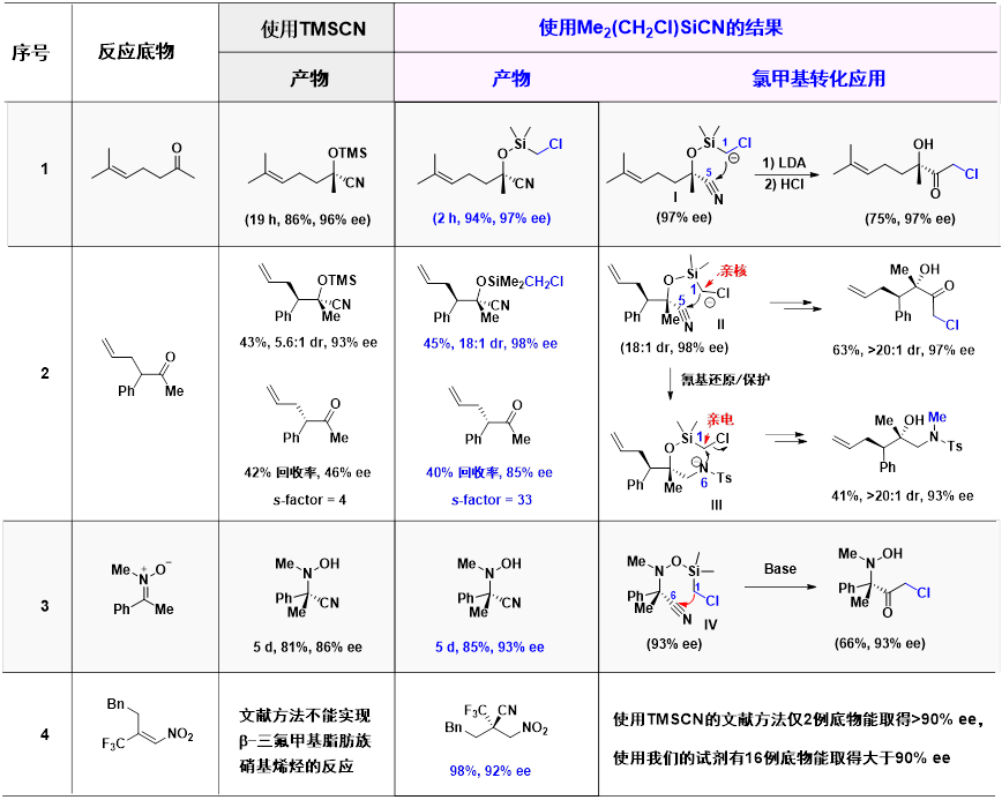
构建氰基取代的手性季碳极具挑战性,周剑教授团队利用Me2(CH2Cl)SiCN发展了酮、酮硝酮和硝基烯烃的不对称氰化反应[1-4],并取得了比传统TMSCN试剂更好的反应活性和选择性(图2)。硅醚产物上的氯甲基不仅可作为亲核试剂进行后续转化,还可作为亲电试剂被利用。
图2 双功能硅试剂Me2(CH2Cl)SiCN在不对称硅氰化反应中的应用
值得一提的是,周剑教授团队利用Me2(CH2Cl)SiCN不仅首次以91% ee值实现了挑战性的甲基乙基酮的不对称亲核加成反应,且该试剂在活性分子(如COX-抑制剂、DP2受体激动剂的关键中间体、马铃薯甲虫信息素)的合成方面具有重要应用(图3)。

图3 Me2(CH2Cl)SiCN在活性分子合成中的应用
双功能硅试剂Me2(CH2Cl)SiCF3的应用
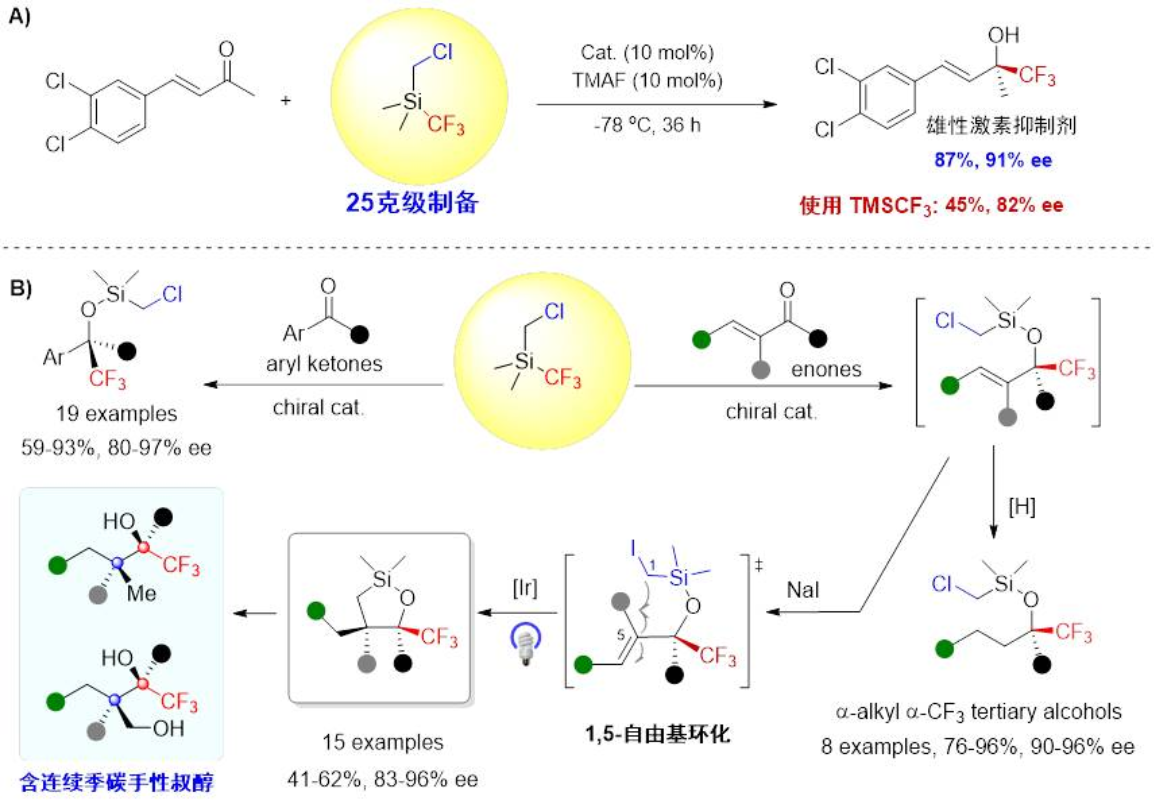
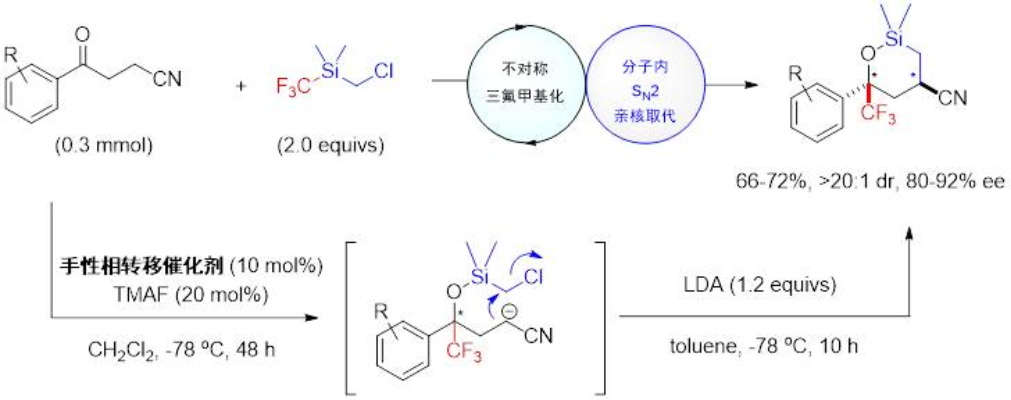
周剑教授团队利用双功能氯甲基三氟甲基硅试剂Me2(CH2Cl)SiCF3实现了首例高对映选择性,高底物普适性的不对称酮的三氟甲基化反应,所有产物的ee值均是目前文献报道的最高值[5]。利用该试剂不仅实现了雄性激素抑制剂的首次不对称催化合成,还通过利用串联反应的发展实现了含连续手性中心的三氟甲基手性五元硅氧杂环的合成(图4)。此外,还利用该试剂发展了β-氰基酮的不对三氟甲基化/分子内SN2环化串联反应,能以良好的产率以及80-92%的ee值和>20:1 dr值获得相应的手性三氟甲基取代的六元硅氧杂环[6]。这些结果很好地说明了双功能氯甲基三氟甲基硅试剂在多样性合成含硅杂环中的潜在应用价值。

图4 双功能硅试剂Me2(CH2Cl)SiCF3在不对称三氟甲基化反应中的应用

周剑,现任华东师范大学上海分子治疗与新药创制工程技术研究中心主任,英国皇家化学学会会士,国家优秀青年基金获得者、国家杰出青年科学基金获得者。2008年起于华东师范大学化学系担任教授,一直围绕“全取代碳手性中心的不对称催化高效构建”开展研究工作。立足于协同催化的理念,通过发展新型手性催化剂、新试剂和新合成策略,从而设计开发新反应,导向具有“全取代碳手性中心”的药物优势骨架的高效构建。

百灵威可提供周剑教授团队研发的下述3类双功能硅试剂,可应用于不对称硅氰化和三氟甲基化反应及其串联反应,反应性更好,立体选择性更高!
产品列表
相关产品
TMSCNTMSCF3
三甲基氟化试剂
参考文献
- Zeng, X.-P.; Zhou, J. Me2(CH2Cl)SiCN: bifunctional cyanating reagent for the synthesis of tertiary alcohols with a chloromethyl ketone moiety via ketone cyanosilylation. J. Am. Chem. Soc. 2016, 138, 8730.
- Wu, W.-B.; Yu, X.; Yu, J.-S. Wang, X; Wang, W.-G; Zhou, J. Constructing Tertiary Alcohols with Vicinal Stereocenters: Highly Diastereo- and Enantioselective Cyanosilylation of α-Branched Acyclic Ketones and Their Kinetic Resolution. CCS Chem. 2022, 4, 2140.
- Xu, P.-W.; Cui, X.-Y.; Chen, C.; Zhou, F.; Yu, J.-S.; Ao, Y.-F.; Zhou, J. Enantioselective Synthesis of Cα‑Tetrasubstituted N‑Hydroxyl-α-amino Nitriles via Cyanation of Ketonitrones Using Me2(CH2Cl)SiCN. Org. Lett. 2021, 23, 8471.
- Chen, C.; Wu, W.-B.; Li, Y.-H.; Zhao, Q.-H.; Yu, J.-S.; Zhou, J. Activation of Chiral (Salen)TiCl2 Complex by Phosphorane for the Highly Enantioselective Cyanation of Nitroolefins. Org. Lett. 2020, 22, 2099.
- Mu, B.-S.; Gao, Y.; Yang, F.-M.; Wu, W.-B.; Zhang, Y.; Wang, X.; Yu, J.-S., Zhou, J. The Bifunctional Silyl Reagent Me2(CH2Cl)SiCF3 Enables Highly Enantioselective Ketone Trifluoromethylation and Related Tandem Processes. Angew. Chem.Int. Ed. 2022, 61, e202208861.
- Lei, C.-W.; Wang, X.-Y.; Mu, B.-S.; Yu, J.-S.; Zhou, Y.; Zhou J. Me2(CH2Cl)SiCF3 Facilitated Tandem Synthesis of Oxasilacycles Featuring a Trifluoromethyl Group. Org. Lett. 2022, 24, 8364.
推荐阅读
周剑教授团队科研成果|新型苄氧基、膦酸酯基、砜基PYBOX配体周剑教授团队科研成果|新型双功能手性膦酰胺-胺催化剂
你的三氟甲基化问题解决了么?
陈庆云院士课题组科研成果 | 氟烷基化试剂——应用广,效率高
潘毅教授科研成果 | IMDN-Tf—一步实现三氟甲基化硼化,高效合成含氟功能分子
毕锡和教授科研成果 | 三氟甲基重氮甲烷(CF3CHN2)的新生——TFHZ-Tfs:安全,无毒,易操作