天然产物Tetrodotoxin (TTX)的简易全合成
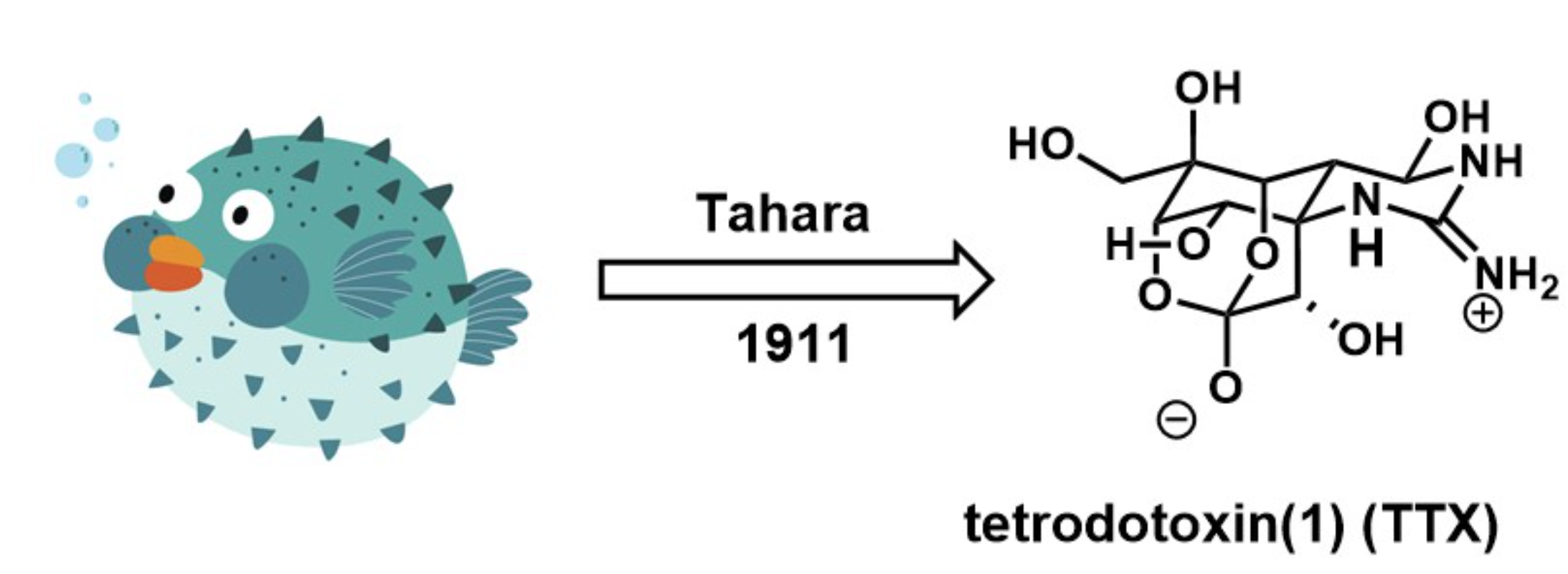
天然产物河豚毒素Tetrodotoxin (TTX) 是由日本科学家Tahara及其同事于1909年从河豚(Spheroides rubripes)的卵巢中分离提取获得(Figure 1)[1],它可作为一种神经毒素,对钠离子通道有抑制作用。
Figure 1 Tetrodotoxin (1)(TTX)的分离
(图片来源于百度)
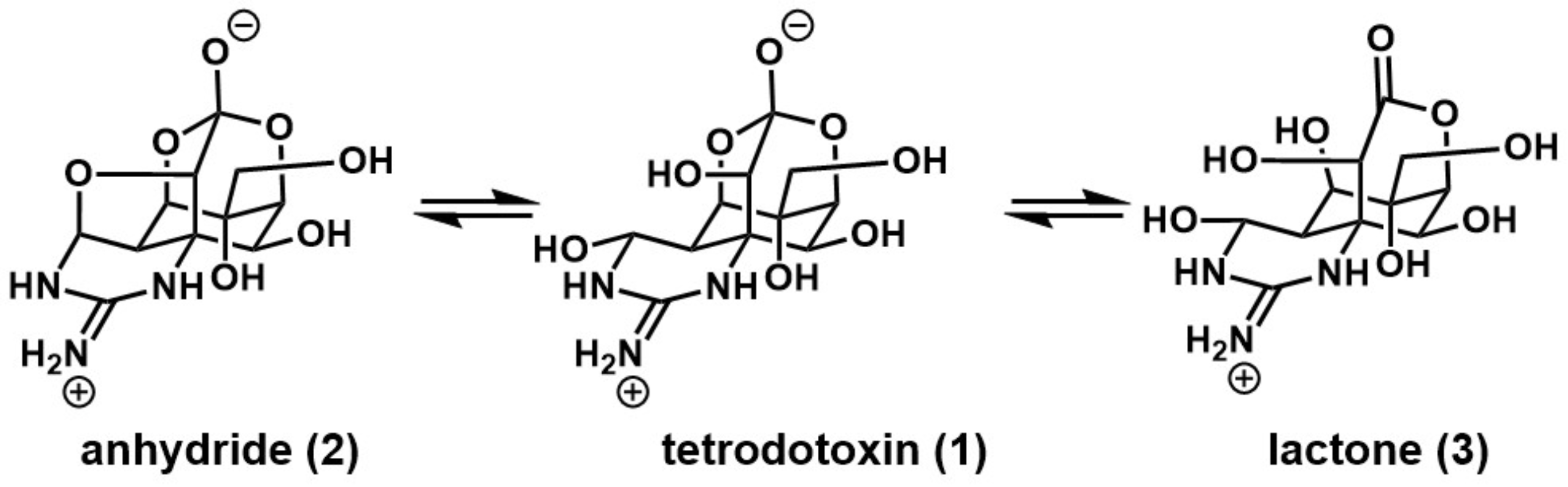
经过长期的努力,Hirata-Goto[2], Tsuda[3],和Woodward[4]三个小组分别得出了河豚毒素的相似结构1(Figure 2)。通过对河豚毒素TTX衍生物的X射线晶体分析,确定河豚毒素TTX的绝对立体化学构型[5],其结构特征在于含有三环原酸酯(二氧杂金刚烷母核)和环胍组成的四环骨架,其骨架被高度氧化(五个羟基取代)。此外,河豚毒素以邻位酯(1)、酸酐(2)和内酯(3)的平衡混合物形式存在[6],如(Figure 2)。
Figure 2 Tetrodotoxin (1)(TTX)的结构
(图片来源于J. Am. Chem. Soc)
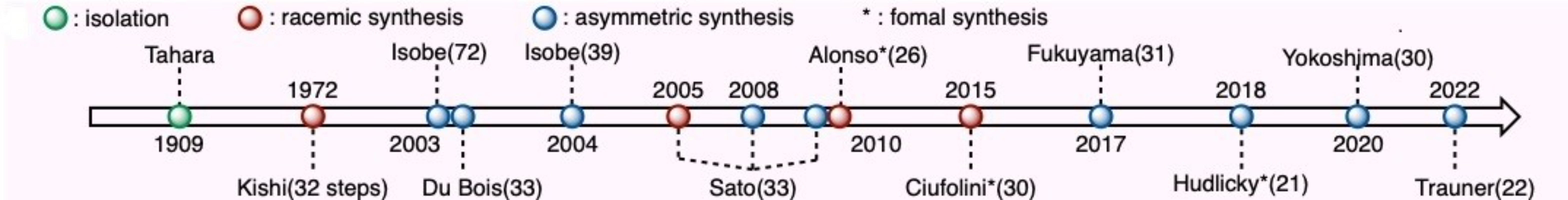
几十年来,化学家们一直致力于该类化合物的合成以及其活性方面的研究,但直到1972年, Kishi和Fukuyama团队就率先完成了外消旋TTX的全合成[6],而到2003年,Isobe课题组完成了首例TTX的不对称全合成[7]。随后,相继有很多课题组完成了该分子的全合成,如Hinman和Du Bois课题组2003年的不对称合成 [8], Isobe课题组2004年的二代合成 [9-10],Sato课题组2005-2010年的消旋体合成及两次不对称合成 [11-13],Yokoshima[14]和Fukuyama团队[15]分别于2017和2020年报道的两种全新的TTX全合成路线(Figure 3)。
Figure 3 Tetrodotoxin (1)(TTX)的合成研究
(图片来源于chem-station 日文版)
近日,美国纽约大学的Dirk Trauner和Bryan S. Matsuura团队在Science上,以 “A concise synthesis of tetrodotoxin” 为题,报道了天然产物Tetrodotoxin (TTX)(1)全合成路线设计,并以 以22步总步骤、11%的总收率实现了河豚毒素相对简洁的立体选择性全合成。 其全合成步骤如下,
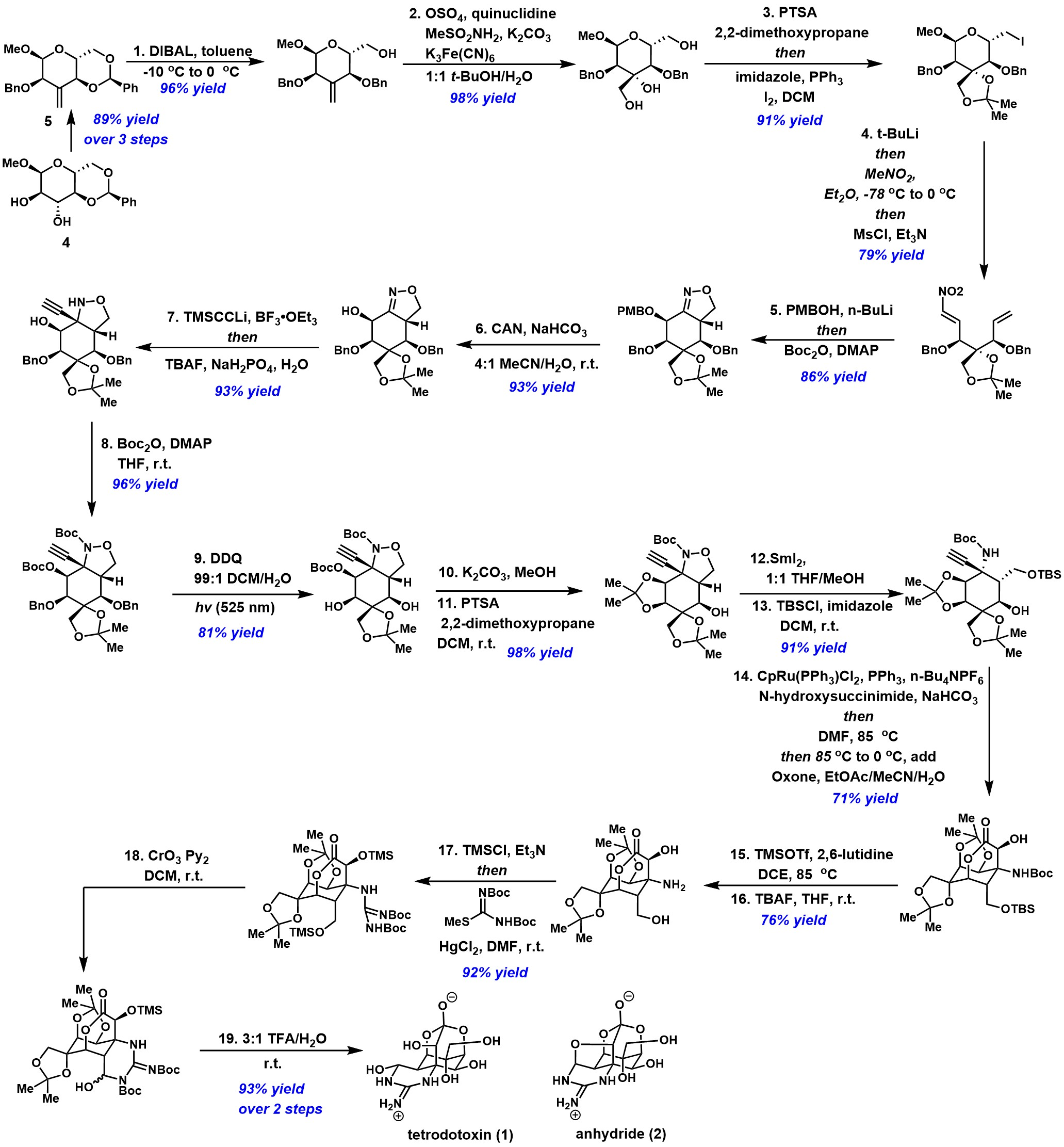
首先,葡萄糖衍生物(4)经过三步反应获得环外双环砌块(5),(5)通过DIBAL作用下发生区域选择性还原合成葡萄糖衍生物(6),(6)的烯烃骨架在OsO4的作用下发生立体选择性双羟基化反应获得叔醇中间体(7),(7)通过apple 反应合成碘代物 (8)。随后,碘代物(8)经还原、Henry反应、甲磺酰化以及原位消除一锅四步获得(E)-烯烃(9),而后(9) 经oxa-Michael加成反应、Boc2O的作用生成氧化腈中间体以及分子内1,3-偶极环加成反应立体专一性获得异噁唑啉(10)[16],随后(10)在硝酸铈铵(CAN)的作用下脱除PMB保护基得到中间体,并在BF3•Et2O的存在下与三甲基硅基乙炔锂发生立体专一性亲核加成获得炔基异噁唑烷(11)[17]。其次,(11) 与Boc2O的作用获得中间体(12),(12)通过Pieber和Seeberger发展的光催化条件下脱出C5和C7位置的苄基获得(13),(13)选择性的脱除羟基的保护基以及缩醛保护合成中间体(14),而后(14) 经SmI2的作用下断裂N-O键以及TBS保护伯醇两步获得砌块(15),(15)通过环化异构化以及臭氧氧化一锅两步获得羟基内酯(16)。接下来,先脱除(16)中的Boc保护基和TBS保护基脱除得到氨基二醇(17),然后原位利用TMS保护羟基获得产物(18)。最后, Kishi发展的条件对(18)进行胍基化得到中间体(19),再在三氧化铬-吡啶络合物的氧化条件下获得半缩醛胺异构体的混合物(20),(20)在3:1TFA/H2O溶液中搅拌过夜,成功地脱除所有保护基并在酸性条件下发生差向异构化和分子内亲核进攻,以良好的收率得到(-)-TTX(1)和4,9-anhydro TTX(2)。
Figure 4 Tetrodotoxin (1)(TTX)的简易全合成
(图片来源于science)
Dirk Trauner和Bryan S. Matsuura等团队在Science上,以 “A concise synthesis of tetrodotoxin” 为题,报道了天然产物Tetrodotoxin (TTX)全合成路线设计,并以22步总步骤、11%的总收率实现了河豚毒素相对简洁的立体选择性全合成。
原文:Enantioselective Total Synthesis of (−)-Caulamidine A. Zhouyang Zhu and Thomas J. Maimone* Science., 2022, 377, 411-415. Doi : 10.1126/science.abn0571
参考文献
- Tahara, Y. J. Pharm. Soc. Jpn. (in Japanese)1909, 29, 587−625.
- Goto, T.; Kishi, Y.; Takahashi, S.; Hirata, Y. Tetrahedron 1965, 21, 2059−2088. doi: 10.1016/S0040-4020(01)98344-9.
- Tsuda, K.; Ikuma, S.; Kawamura, M.; Tachikawa, R.; Sakai, K.; Tamura, C.; Amakasu, O. Chem. Pharm. Bull.1964, 12, 1357−1374. doi: 10.1248/cpb.12.1357.
- Woodward, R. B. Pure. Appl. Chem. 1964, 9, 49−74. doi: 10.1351/pac196409010049.
- Furusaki, A.; Tomie, Y.; Nitta, I. Bull. Chem. Soc. Jpn.1970, 43, 3325−3331.
- (a) Kishi, Y.; Aratani, M.; Fukuyama, T.; Nakatsubo, F.; Goto, T.; Inoue, S.; Tanino, H.; Sugiura, S.; Kakoi, H. J. Am. Chem. Soc.1972, 94, 9217−9219.doi: 10.1021/ja00781a039 (b) Kishi, Y.; Fukuyama, T.; Aratani, M.; Nakatsubo, F.; Goto, T.; Inoue, S.; Tanino, H.; Sugiura, S.; Kakoi, H. J. Am. Chem. Soc.1972, 94, 9219−9221. doi: 10.1021/ja00781a040.
- Ohyabu N., Nishikawa T., Isobe M., J. Am. Chem. Soc. 2003, 125, 8798-8805. doi: 10.1021/ja0342998.
- Hinman A., Du Bois J., J. Am. Chem. Soc., 2003, 125, 11510-115111. doi: 10.1021/ja0368305.
- Nishikawa T., Urabe D., Isobe M., Angew. Chem. Int. Ed. 2004, 43, 4782-4785. doi: 10.1002/anie.200460293.
- Urabe D., Nishikawa T., Isobe M., Chem. Asian J., 2006, 1, 125-135. doi: 10.1002/asia.200600038.
- Sato K., Akai S., Sugita N., Ohsawa T., Kogure T., Shoji H., Yoshimura J., J. Org. Chem., 2005, 70, 7496-7504. doi: 10.1021/jo050342t.
- Sato K., Akai S., Shoji H., Sugita N., Yoshida S., Nagai Y., Suzuki K., Nakamura Y., Kajihara Y., Funabashi M., Yoshimura J., J. Org Chem. 2008, 73, 1234-1242. doi: 10.1021/jo701655v.
- Akai, S.,Seki, H.,Sugita, N., Kogure, T., Nishizawa, N., Suzuki, K., Nakamura, Y., Kajihara, Y., Yoshimura, J.,Sato, K., Bull. Chem. Soc. Jpn. 2010, 83, 279-287.doi: 10.1246/bcsj.20090194
- Maehara T., Motoyama K., Toma T., Yokoshima S., Fukuyama T., Angew. Chem. Int. Ed. 2017, 56, 1549-1552. doi: 10.1002/anie.201611574.
- Murakami K., Toma T., Fukuyama T., Yokoshima S., Angew. Chem. Int. Ed. 2020, 59, 6253-6257. doi: 10.1002/anie.201916611.
- Houk, K. N., Moses, S. R., Wu, Y. D., Rondan, N. G., Jager, V., Schohe, R.,Fronczek, F. R., J. Am. Chem. Soc. 1984, 106 , 3880-3882. doi: 10.1021/jo050342t.
- Diethelm S., Carreira EM., J Am Chem Soc. 2015, 137, 6084-6096. doi: 10.1021/jacs.5b02574.
相关化合物
| 品名 | CAS | 货号 |
|---|---|---|
| 2,2-Dimethoxypropane, 98% 2,2-二甲氧基丙烷 , 98% | 77-76-9 | 101363 |
| 4-Methoxybenzyl alcohol, 98% 4-甲氧基苄醇 , 98% | 105-13-5 | 134868 |
| Chloro(cyclopentadienyl)bis(triphenylphosphine)ruthenium(II), 99% 环戊二烯双(三苯基膦)氯化钌(II) , 99% | 32993-05-8 | 297002 |
| p-Toluenesulfonic acid, 12 wt.% solution in acetic acid 对甲苯磺酸 , 12 wt.% 乙酸溶液 | 104-15-4 | 562397 |
| Methyl 4,6-O-Benzylidene-alpha-D-glucopyranoside 甲基4,6-O-苯亚甲基-α-D-吡喃葡萄糖苷 , 98.0%(GC) | 3162-96-7 | M1125 |
相关阅读
七大系列,上万个产品,助力天然产物全合成研究!天然产物化学——助力提取、修饰、全合成、药理与代谢研究
光延反应的关键中间体——DEAD/DIAD,用于天然产物全合成