碳链增长方法大合集,进来涨知识啦
时间: 2020-04-10
作者: 百灵威
分享:
碳骨架的构建是有机合成中极其重要的环节,碳骨架的构建大部分涉及碳链的增长。但是增长碳链的方法有多少种?究竟哪一种才是适合您的?
只有真正了解了增长碳链的各种反应的优缺点,才能在碳骨架的构建中做到得心应手,信手拈来。
下面小编就把有效增长碳链的方法以及使用中的小tips,统统告诉你!
你准备好了嘛?

一、利用有机金属化合物增长碳链
与格氏试剂的亲核加成反应:
格氏试剂是含卤化镁的有机金属化合物,可通过烷基化、羰基加成、共轭加成等反应与醛、酮、酯、环氧烷等生成相应的醇,可使碳链按照既定结构增长(如下图)。
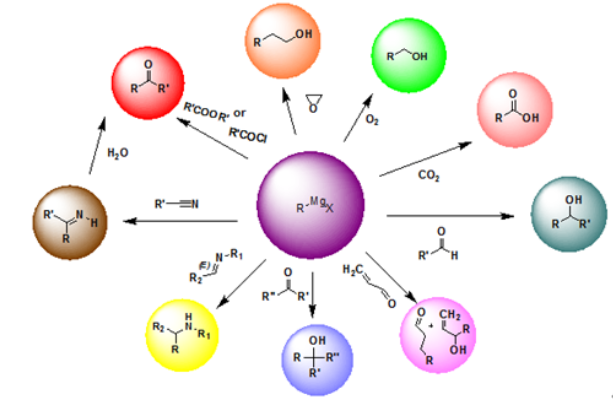
图片来源于网络,如有侵权,请联系我们删除
Tips:
- 格氏试剂极为活泼,遇水变质,遇氧容易氧化,使用过程中注意避免接触水分和空气,拆封后不可久置。
- 格氏反应是放热反应,反应中要控制好反应温度,避免副反应产生,影响实验结果。
与二烃基铜锂偶联:
利用二烃基铜锂与卤代烷发生偶联反应来增长碳链。
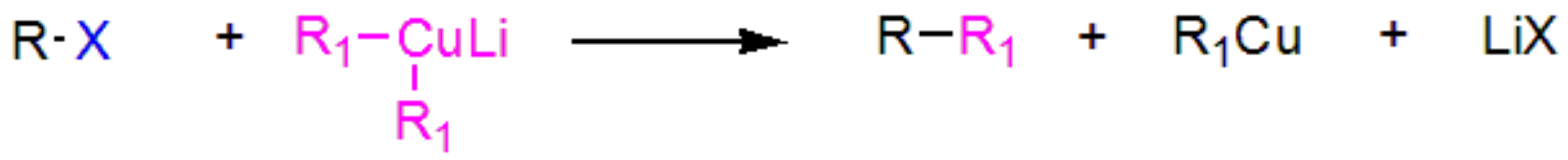
Tips:
- 二烃基铜锂中的烃基与卤代烷的烃基取代范围较广,故反应适用性比较广。
与炔钠亲核取代:
炔钠中的炔负离子具有较强亲和性,可以与卤代烃发生亲核取代反应。

Tips:
- 反应所用卤代烃必须是伯卤代烃(仲卤和叔卤与炔钠生成消除产物,乙烯型卤代烃不与炔钠反应),该反应是由低级炔制备高级炔的重要方法,但限制性较大。
与碱金属的武尔兹反应:
武尔兹反应可以用来从卤代烷(主要是伯卤)制备含偶数碳原子、结构对称的烷烃。

Tips:
- 如果将两种不同卤代烃放在一起反应会产生两种不同烷烃,分离非常困难,此外反应含自由基会产生烯烃副产物,该反应产率较低,较少使用。
威廉姆逊(Williamson)合成法:
该方法是制备混合醚的一种好方法,由卤代烃与醇钠或酚钠作用而得。
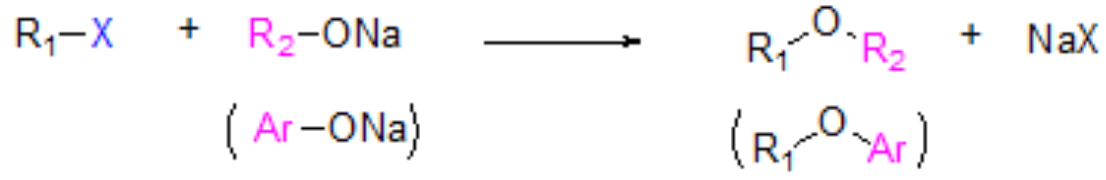
Tips:
- 威廉姆逊合成法只能选用伯卤代烷与醇钠为原料;即可合成对称醚,也可合成不对称醚,但最好用一级卤代烃;反应中同时存在消除副反应,且烷基结构对反应收率影响较大。
二、利用碳原子上的烃基化反应增长碳链
傅-克(Fridel-Crafts)反应:
在路易斯酸催化下,通过亲电试剂与芳烃发生的亲电取代反应来增长碳链,包括傅-克烷基化和傅-克酰基化反应。
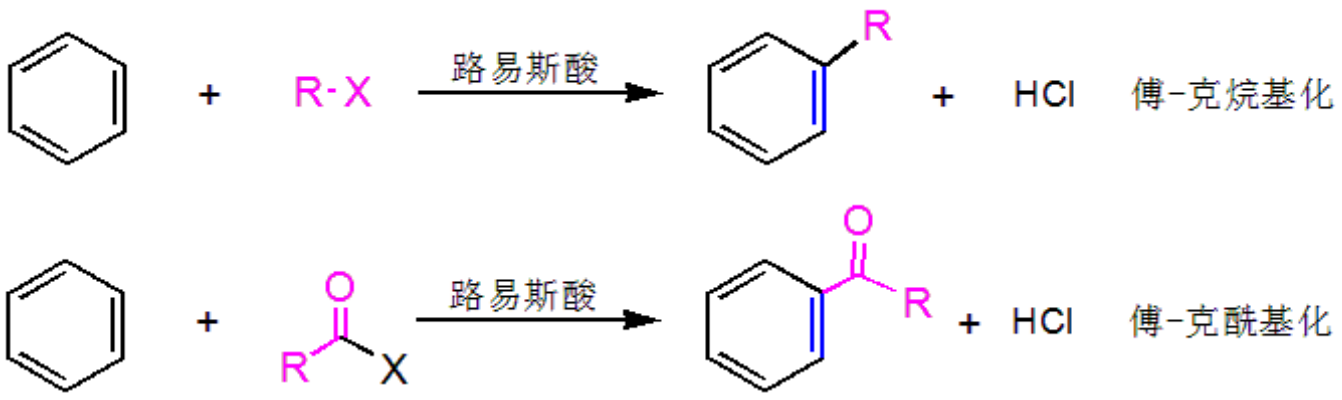
Tips:
- 傅-克烷基化的反应历程经过碳正离子中间体,以碳正离子为亲电试剂进攻苯环,可能发生重排,因此反应很难得到单一产物,应用不广泛。
- 傅-克酰基化中,若环上连有-NO2、-SO3H、RCO- 、-CN等吸电子基团时不发生反应;傅-克酰基化没有异化产物,也没有多元取代产物,制备含3个(含)碳原子直链烷基时,可采取先酰基化,再羰基还原的方法。
酯化反应:
通过羧酸和醇在酸催化作用下脱水生成酯来增长碳链。
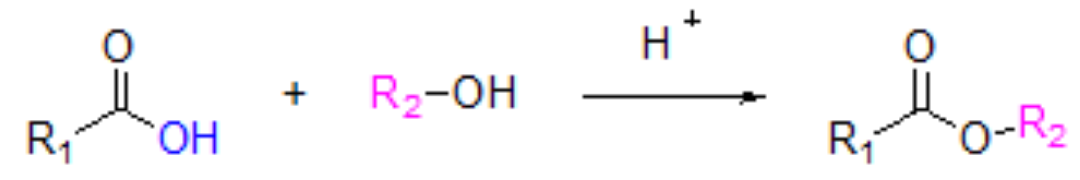
Tips:
- 不同的醇和羧酸发生酯化反应的机理不同,三级醇酯化逆反应比正反应容易,故三级醇酯化产率很低。
三、利用醛酮的加成反应来增长碳链
羟醛缩合反应:
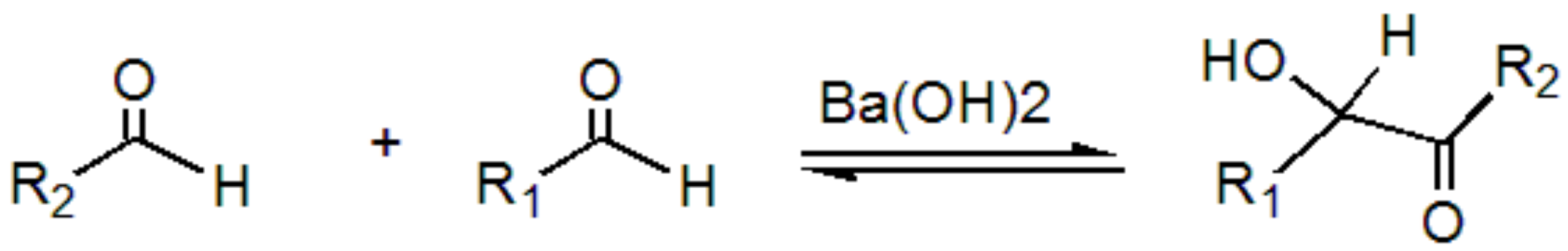
Tips:
- 反应生成的羟醛或酮在加热下易失水,生成α,β-不饱和醛或酮。
与磷叶立德(维蒂稀试剂)的加成反应:
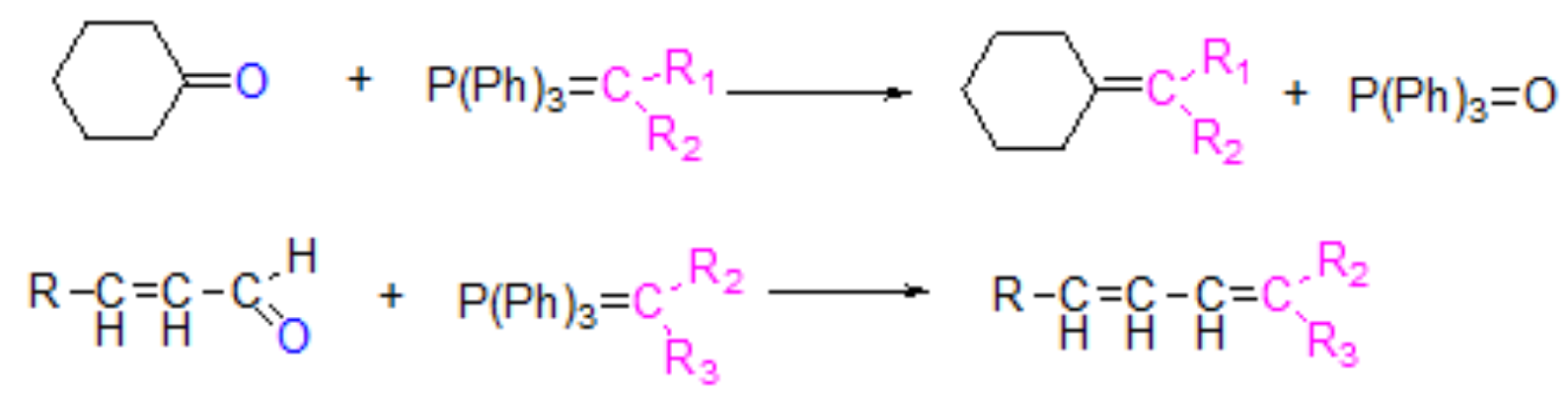
Tips:
- 用于合成特定结构的烯烃;醛酮分子中的双键、三键对反应无影响;此反应无分子重排,产率高。
四、炔烃的亲核加成
炔烃对电子的吸引力强,可以通过炔烃分子内的亲核加成反应来增长碳链。
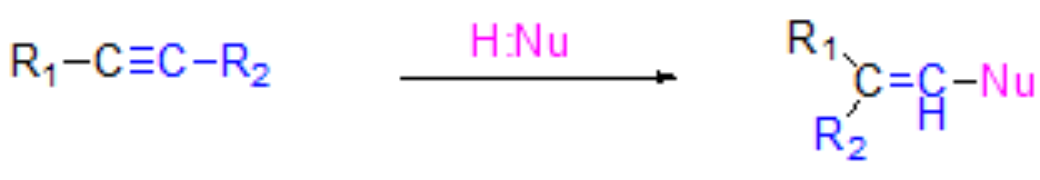
Tips:
- 烯烃不能发生,可利用该法将炔与羧酸反应制备无法用烯醇直接酯化制得的酸烯酯,以及将炔烃与氢氰酸生成烯腈,再水解得到α,β-不饱和酸。
五、狄尔斯-阿尔德(Diels-Alder)反应
狄尔斯-阿尔德反应是由共轭双烯与烯烃或炔烃反应生成六元环的反应,是有机化学合成反应中非常重要的碳碳键形成的手段之一。

Tips:
- 狄尔斯-阿尔德反应条件简单(加热便可),是现代有机合成中常用的反应之一。
六、烯烃加聚反应

Tips:
- 烯烃在高压下,在少量氧的引发下进行自由基加成的链式反应,共轭双烯容易聚合,该反应可制备高聚物,但无法合成特定碳链个数的小分子。
通过小编的分享,你是否已经找到合适的增长碳链方法呢?点击选购合适的产品吧
封面图片来源于网络,如有侵权,请联系我们删除。